[프레스나인] 미국 국립암연구소(National Cancer Institute, NCI)가 미국 암학회에서 국내 바이오벤처인 피노바이오의 새로운 항암제 'Aza-T-dCyd'에 대한 안전성을 입증하고 항암 효능 가능성을 확인한 미국 1상 결과를 발표했다. 피노바이오는 이번 임상 결과를 긍정적으로 판단하고 글로벌 임상을 가속화하겠다는 방침이다.
미국 국립암연구소는 4일(현재 시간) Aza-T-dCyd의 고형암 1상 결과를 미국임상종양학회(ASCO 2021)에서 공개했다.
Aza-T-dCyd은 미국 공공연구소인 서던리서치(Southern Reserach)가 합성한 뉴클레오사이드(Nucleoside) 계열 DNA 메틸전달효소1(Methyltransferase1, DNMT1) 저해 후생유전학 표적항암제 후보물질이다. 피노바이오는 2017년 서던리서치로부터 Aza-T-dCyd의 상업화 개발에 대한 독점권 권리를 확보했다.
DNMT1은 DNA에 '메틸기'가 붙어 발생하는 DNA 메틸화를 일으킨다. 메틸기는 유전자 발현을 억제하는 대사물질이다. 메틸화 유무는 암세포 발생에 주요한 영향을 미친다. 암 억제 유전자가 메틸화되고, 암 유전자가 메틸기의 미부착으로 탈메틸화되면 암세포가 발생한다. Aza-T-dCyd은 암 억제 유전자의 과메틸화를 저해(탈메틸화)해 암 억제 유전자가 정상적으로 발현하게 하는 기전이다.
이번 1상은 표준 치료법이 정해지지 않은 암 환자 및 더 이상의 표준 치료 방법의 적용이 불가능한 말기 암 환자 18명을 대상으로 진행했다. 임상 설계는 Aza-T-dCyd를 총 21일 중 10일(1~5일, 8~12일) 동안 2·4·8·16·32·48mg의 용량군을 경구로 투여하는 방식으로 진행했다. 임상 목적은 안전성과 내약성, 최대내성용량(maximum tolerated dose, MTD) 등 확인이다.
임상 결과, Aza-T-dCyd은 기존 DNMT1 저해제 대비 유사한 수준의 부작용을 보였으며, 효능면에서는 우월한 항암 작용 가능성을 확인했다.
기존 DNMT1 저해제와 같이 백혈구 감소증, 호중구 감소증, 혈소판 감소증 등 Grade2 이하의 혈액학적 부작용이 주를 이뤘으며, 약한 소화기관계 부작용도 관찰됐다.
최대내성용량으로 도출한 32mg의 경우 피험자 총 10명 중 1명의 피험자에서 심각한 부작용(Grade3, 호중구 감소증)이 관찰됐으나, 9명의 피험자에서 심각한 부작용이 발견되지 않았다. 최대 용량 32mg까지 안전성을 확보했다는 의미다. 뉴클레오사이드 약물을 경구로 투약했을 때 흔히 발생하는 위장관계 출혈 부작용도 거의 발견되지 않았다.
Aza-T-dCyd은 경구로 인체에 잘 흡수해 암 조직에 충분한 노출량을 보이는 동시에 용량의존적으로 노출량이 증가해 향후 경구 투여 항암제로 개발될 수 있음을 확인했다. DNMT1 저해제는 정맥주사 제형 '데시타빈', '아자시티딘' 2개가 개발됐다.
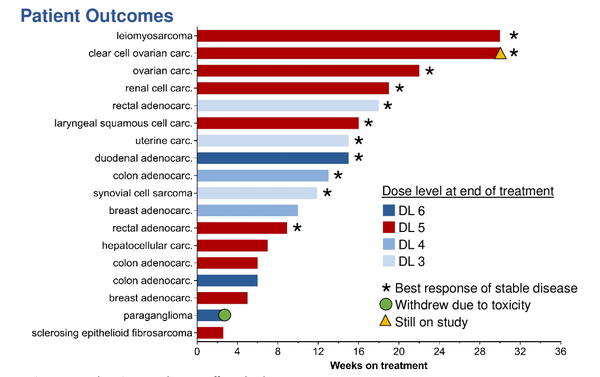
암이 더 이상 커지지 않는 안정병변(Stable Disease, SD) 상태도 확인됐다. 1상은 모집 환자 수가 적은 데다가 안전성과 내약성이 목적이라 객관적인 종양반응률(ORR, 종양 감소 환자비율)은 도출하지 않았지만, 다음 단계 임상에서 좋은 효능을 기대할 수 있는 징후를 파악한 것으로 해석된다.
Aza-T-dCyd은 피험자 18명 중 14명의 환자에서 투여가 2개월 이상 지속돼 암 치료 반응을 관찰했다. 14명 중 11명에서 암의 진전이 안정화되는 SD가 확인됐다. 약물 치료 효과로 종양 조절된 환자수인 질병통제비율(Disease Control Rate, DCR)은 78.6%로 조사됐다.
SD 11명 중 2명(평활근육종 환자 1명 및 난소암(투명세포암) 환자 1명)은 SD가 6개월 이상 유지했다. 3명의 환자(난소암, 신장암, 직장암)에서는 4개월 이상 유지하는 SD 상태를 확인했다. 1명 환자에서는 매우 낮은 투여 용량인 8mg 투여량에서도 4개월 이상 지속하는 SD가 관찰됐다. Aza-T-dCyd은 일부 암종에서 4개월 이상 치료 반응을 보여 단독 또는 표준치료제와 병용요법으로 사용할 수 있는 가능성을 확인한 셈이다.
피노바이오는 혈액암 대상으로 Aza-T-dCyd의 미국 임상 1상(코드명: NTX-301)을 진행하고 있다. 고형암 대상으로 Aza-T-dCyd와 표준치료제 화학요법과 병용하는 호주 1/2상(NTX-303)을 실시하고 있다.
피노바이오 관계자는 "Aza-T-dCyd(NTX-301/303)의 인체 안전성과 경구 투여 가능성이 최초로 확인됐다"며 "인체에서의 항암 효력 가능성도 파악됐다"고 말했다.
이어 "기존 DNMT1 저해제와 비교 시 동등 수준의 우수한 안전성이 확인됐고 기존 약물에 대해 꾸준히 제기되던 보다 개선된 항암 효능을 달성할 수 있는 가능성을 나타냈다"며 "NTX-301과 303의 자체 임상 개발을 가속화해 환자에서의 효력을 빠르게 입증하기 위해 노력하겠다”고 강조했다.

