올해 '항암신약 중심 글로벌 제약사' 제시…아베오 인수로 밑바탕 마련
[프레스나인] LG화학이 항암제 시장 진출을 위한 행보를 이어가는 가운데 국내에서도 연구개발에 힘을 싣는 모습이다.
LG화학은 지난 4일 식품의약품안전처로부터 차세대 면역관문 억제제 후보물질인 'LB-LR1109'의 임상1상 시험을 승인 받았다.
LB-LR1109는 ‘LILRB1(Leukocyte Immunoglobulin Like Receptor B-1)’ 억제 기전의 단일 항체 약물이다. 다양한 면역세포에서 발현되는 면역관문(면역계 회피) 신호 분자인 LILRB1과 암세포에서 발현돼 면역세포의 공격을 막는 단백질인 HLA-G(Human Leukocyte antigen-G)의 결합을 방해해 체내 면역세포 전반의 기능을 동시다발적으로 활성화하는 역할을 한다.
타깃이 되는 LILRB1은 대표적인 면역세포인 T세포는 물론 NK세포(자연살해세포), 대식세포(식균세포) 등 다수 면역세포의 표면에 공통적으로 발현된다는 특징이 있으며, 따라서 T세포 등 단일 면역세포 작용에만 초점을 맞춘 기존의 면역관문억제제와 뚜렷한 차별점이 있다.
지난해 12월 미국 FDA로부터 임상시험계획을 승인 받았으며, 이번에는 국내에서도 임상시험을 승인 받아 진행하게 됐다.
LG화학은 올해 초 항암신약 중심의 글로벌 제약사로 도약하겠다는 비전을 밝힌 바 있으며, 이를 위해 글로벌 시장에서 적극적인 연구를 이어가고 있다.
특히 지난 2022년 인수한 아베오 파마슈티컬스가 중추적인 역할을 하는 모습으로, 올해 초에는 두경부암 신약물질 '파이클라투주맙'의 미국 임상3상 시험의 첫 시험자를 등록해 개발을 본격적으로 진행하고 있다.
아베오는 이미 신장암 치료제 '포티브다'를 FDA로부터 허가 받아 판매하고 있으며, 이번에 승인 받은 LB-LR1109의 미국 임상 역시 아베오가 진행한다. 포티브다의 신장암 2차 치료제 사용을 위한 미국 임상3상도 함께 진행 중이다.
이처럼 LG화학은 그동안 아베오를 통해 미국에서의 항암제 개발에 주력해왔는데, 이번에는 그 범위를 국내까지 확장한 것이다.
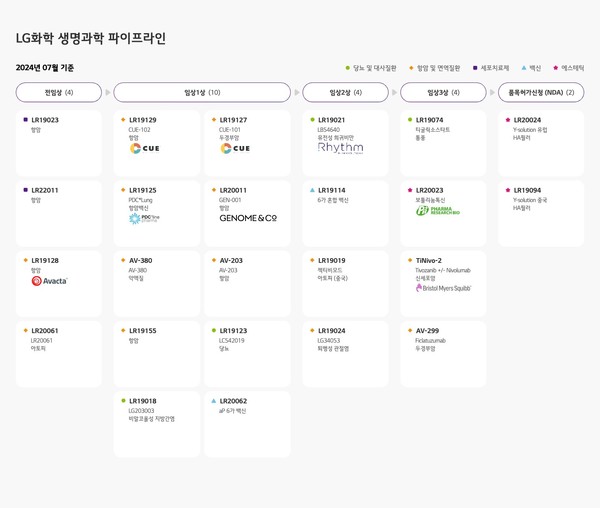
현재 LG화학이 보유한 항암제 관련 파이프라인이 9개에 달한다는 점을 감안하면, 이후 파이프라인에 대해서도 순차적으로 국내 임상을 진행할 가능성이 높다.
시장 규모가 큰 해외에서의 임상을 우선적으로 진행하고 있지만, 국내에서도 임상시험을 진행, 향후 개발에 성공할 경우 국내에서도 품목허가를 받아 판매하려는 것으로, 항암제 시장 진출을 위해 더욱 광범위한 움직임을 펼칠 것으로 전망된다.