FDA 혁신치료제로 지정...2b상서 환자 75% 이상 저혈당증 개선
[프레스나인] 한독이 투자한 미국 바이오텍 레졸루트(Rezolute)가 신약 임상 3상의 환자 모집을 마무리했다. 올해 말 주요 데이터가 도출되며 신약개발 성공 여부가 판가름날 예정이다.
레졸루트에 따르면 회사는 지난달 선천성 고인슐린증(HI)으로 인한 저혈당증 치료제 RZ358(성분명 에르소데투그, ersodetug)의 임상 3상 환자 모집을 종료했다. 앞서 발표된 일정대로다.
이번 임상은 3개월에서 45세 사이 환자를 대상으로 RZ358의 효능 및 안전성을 평가하기 위해 설계됐다. 당초 환자 56명 등록이 예정됐으나 초과 모집이 이뤄져 최종 62명이 등록됐다.
환자는 ▲1세 이상 대상 RZ358(5mg/kg)과 표준치료법(SOC) 병용요법 투여군 ▲1세 이상 대상 RZ358(10mg/kg) 단독요법 투여군 ▲3개월~1세 영유아 대상 RZ358(5~10mg/kg)과 SOC 병용요법 투여군 등 3개 그룹으로 나뉜다.
브라이언 로버츠 레졸루트 최고의료책임자는 “올해 말 최종 데이터를 발표할 수 있기를 기대한다”며 “임상 데이터를 바탕으로 2026년 RZ358에 대한 허가 신청(BLA)을 제출할 수 있는 명확한 경로를 예상한다”고 말했다.
선천성 고인슐린증은 인슐린이 과도하게 분비돼 저혈당증을 유발하는 희귀질환이다. 2만5000~5만명당 1명 꼴로 발병하는 것으로 알려져 있다. 환자는 일반적으로 생후 첫 달 이내에 저혈당증의 징후나 증상을 보인다. 이는 적절한 치료가 이뤄지지 않을 경우 심각한 뇌 손상 및 사망으로 이어질 수 있다.
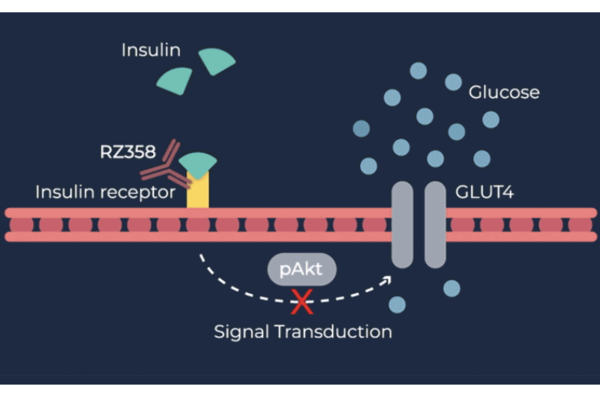
RZ358은 인슐린 수용체 특정 부위에 작용하는 단일클론항체다. 인슐린 및 관련 물질에 의해 수용체가 과도하게 활성화하지 않도록 막음으로써 저혈당증을 개선한다.
앞서 임상 2b상에서 RZ358은 환자 75% 이상의 저혈당증을 안전하게 개선한 것으로 나타났다. 이런 데이터를 기반으로 올해 초 미국 식품의약국(FDA)으로부터 혁신치료제(Breakthrough Therapy)로 지정되기도 했다. 혁신치료제로 지정된 의약품은 개발 기간 단축, 허가 심사 우선 처리, 규제 기관과의 협력 강화 등 다양한 혜택을 받는다.
레졸루트는 RZ358을 종양 매개성 고인슐린증으로 인한 저혈당증의 치료제로도 개발하는 중이다. 5월부터 임상 3상 환자 모집을 시작한 것으로 파악된다.
한편 한독은 2019년 처음 레졸루트에 투자한 뒤 현재 지분 11.88%를 보유하고 있다.