[프레스나인] 체외진단 의료기기를 신의료기술평가 이전에 먼저 출시할 수 있는 가능성이 열리면서 관련 업계에 기대감이 감돌고 있다.
보건복지부는 지난 5일 체외진단 의료기기가 신의료기술평가를 유예할 수 있는 ‘신의료기술평가에 관한 규칙’ 일부개정안을 6일부터 내달 18일까지 입법예고했다.
신의료기술평가는 새로운 의료기기나 의약품 등을 출시하기에 앞서 안전성과 유효성 등을 평가하는 제도다.
정부는 그간 체외진단 의료기기를 신의료기술평가 유예 적용 대상에서 제외했다. 더욱이 체외진단검사 ‘선 진입, 후 평가’ 제도 역시 감염병만을 대상으로 해 다른 질환에 대한 적용이 어려웠다.
반면 신의료기술평가 유예 대상에 포함되면 정해진 요건을 충족할 경우 해당 의료기기를 사용하는 의료기술의 조기 시장진입이 허용된다. 신의료기술평가 역시 일정 기간(2년) 유예된다.
업계는 고무적이라는 평가다.
이러한 규제 완화가 신제품의 조기 도입을 가능케 해 환자 진단 및 치료는 물론 회사 매출에 긍정적인 영향을 미칠 것으로 업계는 기대하고 있다. 신의료기술평가제도에 체외진단기기를 포함하는 것은 불합리하다는 게 그간 업계 주장이다.
한 의료기기 업체 관계자는 “체외진단 분야는 제도적으로 답답한 부분이 많았다”면서 “선 진입, 후 평가 제도가 있지만 감염병만 적용됐다. 감염병 외에도 가치가 있는 영역이 많은데 제도가 너무 좁게 운영됐다”고 지적했다.
이 관계자는 이어 “체외진단 분야는 혁신의료기술이나 제한적 의료기술에서도 배제됐다”면서 “이로 인해 새로운 제품 도입이 지연된 사례가 종종 발생했다”고 전했다.
이에 따라 지난 6월 중순, 한국의료기기산업협회는 회원사들의 의견을 모아 제도 개선을 요구하는 의견서를 한국보건의료연구원(NECA)에 전달했다.
앞선 관계자는 “정부가 우리의 제안을 수용한 건 매우 고무적”이라며 “신의료기술평가 유예 적용은 체외진단 업계의 숙원사업이었다. 정책적으로 실현돼 기쁘다”고 말했다.
다만 새로운 규정에 대한 면밀한 검토가 필요하다고 강조했다.
이 관계자는 “선 진입, 후 평가 제도도 처음엔 기대가 컸지만 나중에 감염병만 적응증이 돼 업계의 실망이 컸다”면서 “생각보다 규제가 많을 수 있다. 세부내용을 면밀히 검토할 예정”이라고 전했다.
다른 의료기기 업체 관계자도 “구체적인 내용을 더 파악해 봐야 할 것"이라며 "정부가 제도 개선에 나선 부분은 긍정적이라고 보고 있다”고 말했다.
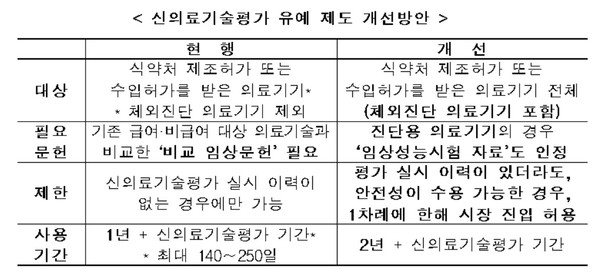
복지부가 입법예고한 ‘신의료기술평가에 관한 규칙’ 일부개정안에선 체외진단 의료기기를 신의료기술평가 대상에서 유예하고, 신의료기술평가 이력이 있을 경우 이미 실시된 평가에서 안전성의 우려가 없는 것으로 판단되면 한 차례 평가유예 및 선사용 기회를 제공한다.
평가 유예 기간은 기존 1년에서 2년으로 연장된다.
안전성에 대한 우려가 적은 진단용 의료기기는 의료현장에서 사용 중인 의료기술과 비교한 임상시험 결과가 없더라도 식약처 허가 시 제출된 ‘임상성능시험 자료’만으로도 유예신청이 가능하다.
또한 평가유예 의료기술, 제한적 의료기술, 혁신의료기술로 구분해 각 위원회에서 관리해온 선진입 의료기술은 ‘근거창출지원위원회’로 일원화해 안전성에 대해 심의할 예정이다.


