SUSAR 중 단 0.7%가 투약 중단으로 이어져
임상1상 저용량에서 투약 중단 되는 경우 더욱 심각한 상황으로 판단
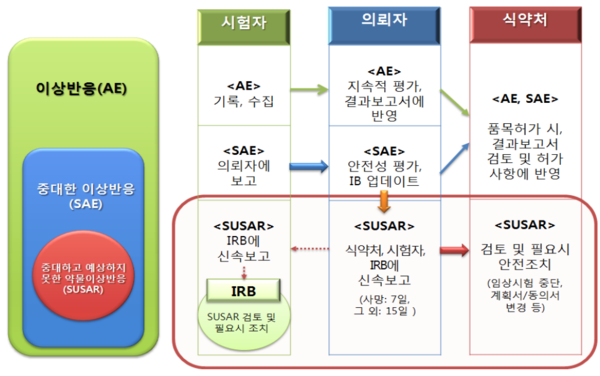
[프레스나인] 항암제 임상에서 SAE(중대한 이상사례, Serious Adverse Event)는 흔한 일이 맞다. 하지만 SAE가 약물 투약 중단으로 이어지는 경우는 매우 드물다.
“Fundamental & Clinical Pharmacology”에 공개된 연구 결과에 따르면 분석한 8,676건의 SAE중 단 3%(270건)가 SUSAR였다. 270건의 SUSAR 중 투약 중단으로 이어진 건은 단 2건에 불과 했다. 연구 대상이었던 8,676건의 SAE 중 0.02%가 투약 중단으로 이어진 것이다.
SAE가 발견되면 회사의 약물감시(Pharmacovigilance)팀은 모든 역량을 동원해 SAE가 SUSAR(중대하고 예상하지 못한 약물이상반응, Suspected Unexpected Serious Adverse Reaction)가 아니라고 입증하려 한다.
SUSAR로 판단되면 임상시험심사위원회(IRB, Institutional Review Board), 데이터안전성모니터링위원회(DSMB, Data Safety Monitoring Board)에 보고되고 검토가 된다. 이때는 최고의학책임자(CMO, Chief Medical Officer)가 나서 투약 중단으로 이어지지 않도록 최선을 다한다. 그럼에도 불구하고 0.02%는 환자보호를 위해 투약 중단 결정이 내려진다.
이처럼 투약 중단으로 이어지는 안전성 문제는 매우 드문일이다. 그만큼 심각한 일이다. 특히 임상1상 저용량에서 투약 중단이 되는 일은 더욱 심각한 일이라고 판단된다.