임상 1상 저용량에서 독성 문제로 투약 중단 되었다면 개발 중단해야
Val-Cit PABC 링커 문제 없으면 왜 ORM-6151에 β-glucuronide 링커로 변경했나?
[프레스나인] 임상1상 저용량에서 독성 문제로 투약이 중단되면 대부분 개발을 중단한다. 독성이 발생 용량에서 용량을 더 낮추어 임상 2상을 진행해야 한다. 효능이 있기가 어렵다.
임상 1상은 저용량에서 시작해 고용량으로 단계적으로 높여가는 과정이다. 통상 임상 1상에서는 비임상을 통해 산출한 최대 허용 용량의 10분의 1(Safety factor)을 시작용량으로 책정한다. 저용량은 상당히 낮은 용량이다. 그런데 저용량에서 용량을 더 낮춰 임상 2상을 진행한다는 것은 어리석은 일이다.
그런데 최대 허용 용량의 10분의 1을 사용했는데 왜 독성 문제가 발생했을까? 이는 항체-약물 접합체(ADC)에서만 발생할 수 있는 현상이다. ADC는 통상 ‘약물의 최대 허용 용량의 10분의 1’과 ‘페이로드(Payload)의 최대 허용 용량’을 비교해서 더 낮은 용량으로 시작용량을 결정한다. FDA가 페이로드만 따로 독성을 검토하게 하는 것은 링커가 부러지는 리스크를 관리하기 위해서다. 이렇게 계산했을 경우 페이로드의 최대 허용 용량이 시작용량이 될 수 밖에 없다. 페이로드는 항체에 비해 독성이 매우 강한데 무게는 200분의 1정도 밖에 안되기 때문이다. 페이로드가 대부분 조기 방출 되면 저용량에서도 독성 문제가 불거질 수 있는 것이다.
항암제 임상에서 SAE(중대한 이상사례, Serious Adverse Event)는 흔한 일이다. 하지만 SAE 중 단 3%만 중대하고 예상하지 못한 약물이상반응(SUSAR, Suspected Unexpected Serious Adverse Reaction)으로 판명되고, SUSAR 중 단 0.7%만 약물 투약 중단으로 이어진다. ‘별거 아닌 일’이 아니다.
저용량에서 독성 문제로 투약이 중단 되었다는 것은 대부분의 페이로드가 암세포에 도달하기 전 혈중에서 떨어져 나갔다는 반증이다. 개발 중단 말고 다른 선택지는 없다고 판단된다.
오름테라퓨틱의 유일한 파이프라인 유방암 신약 ORM-5029에 사용된 Val-Cit PABC 링커는 오래된 1세대 링커다. 엔허투가 사용하는 ‘enzyme-cleavable GGFG’ 같은 차세대 링커에 비해 안정성(Stability)이 떨어진다.
더욱이 오름테라퓨틱의 페이로드 분자접착제(Molecular glue)는 소수성(Hydrophobic)으로 친수성(hydrophilicity) 링커를 사용했어야 하는데 오히려 소수성에 가까운 Val-Cit PABC 링커를 사용해 안정성을 더욱 해친 것이다. 경영진도 이런 문제점을 파악하고 ORM-6151의 경우 친수성(hydrophilicity)인 β-glucuronide 링커로 변경한 것으로 보인다. Val-Cit PABC 링커의 안정성이 매우 뛰어나다면 ORM-6151에도 사용했을 것이다. 그런데 그러지 않았다.
단백질 분해제(TPD)를 페이로드로 사용하기 위해서는 TPD에 특화된 새로운 링커를 개발했어야 한다. 일반 화학항암제 페이로드에 사용되던 링커를 그대로 사용한 것 자체가 패착이었다고 판단된다.
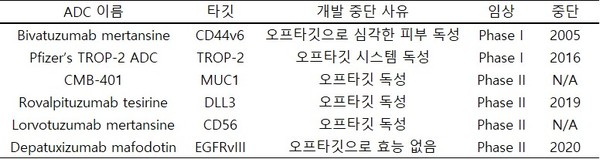
실패한 ADC들을 분석해보면 대부분 효능이 기대에 못미쳐서가 아니라 페이로드의 조기 방출로 인한 독성 문제로 개발이 중단 되었다. 페이로드 조기 방출 문제가 있으면 효능은 볼 필요도 없었던 것이다.